Зачем нужен врач генетик. Генетик. Чем занимается данный специалист, какие исследования производит, какие заболевания лечит? Что представляют собой генетические исследования
На сегодняшний день, семья, планирующая беременность, не обойдется без врача-генетика. Что же он делает, чем помогает пациентам при приеме, и в каких ситуациях человеку стоит обратиться – подробнее ниже.
Врач-генетик: что он делает
Для того, чтобы поняли, кто такой генетик, и чем он занимается, необходимо четко понимать, что такое генетика. Генетика – это наука о наследственности, ее закономерности и изменчивости. Зародилась эта наука еще со времен начальных этапов собирательства и скотоводства. В то время, когда люди постигали для себя совершенно новые знания о выращивании растений, их жизнеспособности в той или иной среде, объемов урожая, и наконец, вкусе. Когда племена начали одомашнивать животных, разводить скот и вспахивать поля с помощью животных, можем услышать первые отголоски генетики. Следовательно, генетик – это ученый, изучающий данную науку.
Самым именитым первопроходцем в генетике стал Грегор Мендель.
С 1865 года он проводил опыты над растительными гибридами и, при скрещивании гороха, обнаружил? что ряд признаков передаются по наследству. Менделя беспрестанно критиковали и не верили в его труды, но он вывел 3 закона.
Они позже и были названы в его честь:
- Закон единообразия гибридов первого поколения;
- Закон расщепления признаков;
- Закон независимого наследования признаков.
Термин «ген» и название «генетика», ввели в лексикон У. Бэтсон и В. Йогансен, в начале 20-го века.

В генетике есть множество разделов, от классической до генетической генеалогии.
Что делает генетик: когда нужно посещать
Врач-генетик – это медицинский специалист, занимающийся диагностированием, лечением и профилактикой патологий, которые возникают из-за наследственности. Все чаще человек проходит генетика, когда необходима консультация при планировании беременности, это помогает избежать катастрофических итогов и узнать все риски зачатия и рождения ребенка.
Особенно актуально посещение генетика, в случаях, когда:
- У родителей есть риск наследственных заболеваний;
- Ребёнок зачат или планируется зачатие у кровных родственников;
- В случаях, когда неизвестна наследственность;
- Когда у взрослого человека или ребенка подозревается генетическое заболевание.
Врач-генетик занимается лечением наследственных заболеваний, вызванных или предрасположенностью, или сексуальной связью между кровными родственниками. Причиной того, что к генетикам обращаются пары, желающие зачать ребенка, служит тот факт, что врач данной специализации может оценить и рассчитать степени риска появления генетических заболеваний.
Также, врач-генетик выявляет, являются ли носителями потенциальные родители, и, если ответ положительный, обязан доступно объяснить возможные последствия для ребенка и риски проявления болезни.
Генетик не лечит точечно, то есть, не занимается лечением конкретного органа, его задача – выявить или опровергнуть наличие того или иного наследственного заболевания.
Генетик при беременности: что делает
Единственно важная причина, по которой будущие родители обращаются к врачу-генетику – возможность рождения нездорового ребенка. Ведь ни один родитель не хочет, чтобы ребенок мучился всю жизнь.
Настолько глубоко генетика, как медицинское направление, изучается только последние 30 лет. Определимся с важнейшим понятием – генетический код. Генетический код – это система буквенного обозначения состава белков в ДНК. Изучается он уже давно.
Каждый человек имеет белки, у которых, в свою очередь, существует свое строение, заложенное родителями, оно и определяет цвет:
- Глаз;
- Кожи;
- Волос.
Клетки не останавливаются только на этом, далее они вырабатывают еще белки, благодаря им, у людей определяется рост и вес и множество других показателей. Есть причины, по которым стоит обратиться за консультацией к генетику. Это провальные попытки забеременеть, частые, постоянные выкидыши (чаще всего, происходит из-за генетических проблем зародыша), в этом случае, консультации и анализ ситуации, в большинстве своем, решают эти проблемы.
В этом возрасте и старше повышается риск наследственных заболеваний, таких как синдром Дауна и прочее. Сдача крови на генетику во время беременности необходима в тех ситуациях, когда существует наследственное заболевание у кого-то из родителей, наркомания, алкоголизм и прием различных препаратов в первый триместр беременности, и, если в семье уже есть ребенок с генетической патологией любого характера.

УЗИ необходимо сделать не позднее 14-й недели беременности, именно в это время генетик может выявить пороки развития, отклонения от норм развития, в этом случае, есть возможность лечить ребенка, не дожидаясь его рождения, еще в утробе матери. Это единственное спасение в том случае, когда ребенок болен, но не доношен, и его преждевременное рождение еще хуже, чем само заболевание. Врач сам может запросить генетический анализ крови, если его не устроили биохимические тесты. Очень важно обратиться к врачу-генетику, если у будущей матери внутриутробная инфекция. Также, существуют заболевания, которые передаются только мужскому или женскому полу. В этом случае, при таком риске, врачи настаивают на лабораторном выборе пола ребенка.
Суть приема у генетика
Генетики отбирают женские и мужские сперматозоиды и вводят в матку более благоприятные. Генетический анализ помогает выявить риски и родить здорового ребенка. Есть различные варианты обследования, каждый из этих вариантов способны решать определенные проблемы.
Например:
- Изучение анализов и родословных родителей потенциального ребенка. Зачатие и рождение детей – это сложный процесс, доктор обязан отвечать за то, что он сделал максимум зависящих от него действий, в случаях риска генетических заболеваний.
- Не инвазивные методы – ультразвуковое исследование выявляет риск рождения с генетическими патологиями, но только на ранних сроках беременности.
- Биопсия хориона – анализ ткани, из которой состоит плацента. Генетические клетки, из которых состоит хорион, совпадают с теми, из которых состоит эмбрион. Следовательно, если в клетках хориона есть патология, то и у плода она тоже есть.
- Амниоцентез – забор околоплодных вод, в них присутствуют частички старого эпителия эмбриона. В случае, если в генах их этих частичек есть патологи, у самого ребенка есть генные дефекты.
- Кордоцентез – анализ крови из пуповины, производится внутриутробно, таким образом исследуется кровь именно ребенка.
Если существуют дефекты и патологии, доктор поясняет все возможности заболевания и прогнозы лечения и жизни ребенка.
Генетика – это наука, занимающаяся изучением закономерностей наследственности и изменчивости человека, хотя существует генетика животных, микроорганизмов, растения и иные. Генетик является специалистом, который исследует механизмы передачи различных заболеваний от одного поколения к другому. Дело в том, что каждая патология имеет свои закономерности, так, не в обязательном порядке носители дефективного гена передадут его своему потомству. Кроме того, даже носительство определенного гена не всегда значит болезнь организма.
Такая специальность, как генетик, является достаточно востребованной, ведь в мире, согласно статистике, 5% детей появляются на свет с различными врожденными заболеваниями.
Наибольшую распространенность имеют:
Гемофилия;
Синдром Дауна;
Дальтонизм;
Спина Бифида;
Вывих бедра.
Наследственные и врожденные патологии значительно снижают качество жизни человека, сокращают её продолжительность, требуют оказания грамотной медицинской помощи . Коснуться проблема рождения больного ребенка может любую семейную пару, так как люди несут груз мутаций генов от предшествующих поколений, а также эти мутации возникают в половых клетках самих родителей.
Когда следует обратиться к генетику?
Обратиться за консультацией к специалисту необходимо на этапе планирования беременности.
Особенно это актуально для следующих пар:
Супруги, которые столкнулись с проблемой бесплодия.
Женщины, которые имеют вторую неразвивающуюся беременность.
Повторные случаи самопроизвольных выкидышей.
Выявленные наследственные заболевания в условиях семьи.
Возраст женщины старше 35 лет.
Пороки развития плода, которые были обнаружены во время планового УЗ-скрининга.
Консультация генетика может потребоваться ребенку. Так, в педиатрии наука позволяет подтвердить или опровергнуть хромосомные или наследственные болезни у ребенка. Обязательно малыша нужно привести к генетику, если у него имеется ЗПР, нарушения в физическом или психоречевом развитии, имеются врожденные пороки или аутистические расстройства.
Не стоит думать, что консультация генетика – это какая-то необычная процедура. Она относится к разряду специализированных медицинских услуг и направлена на оказание помощи больному. Её цель – выявление и профилактика наследственных болезней и пороков развития.
Помощь генетика позволяет своевременно начать профилактику, в том числе и дородовую, осуществить комплексную пренатальную диагностику плода, если есть генетический риск развития ребенка. Если врожденные аномалии подтверждаются, то генетик может дать предварительный прогноз развития и жизни ребенка. Возможно, будет изменена тактика ведения беременной женщины, предприняты меры по выполнению терапевтический, либо хирургической коррекции выявленных нарушений.
Нашли ошибку в тексте? Выделите ее и еще несколько слов, нажмите Ctrl + Enter
Акушер-гинеколог – вот тот врач, который чаще всего отправляет семейные пары на консультацию к генетику, педиатры и неонатологи – специалисты, рекомендующие консультацию у генетика детям и новорожденным.
Причины, для обращения к генетику, могут быть следующими:
Первичное бесплодие;
Первичное невынашивание беременности;
Мертворождение или выкидыши;
Имевшиеся врожденные и наследственные болезни в семейном анамнезе;
Заключение брака между близкими родственниками;
Планирование процедуры ЭКО и ИКСИ;
Неблагополучный ход беременности с риском хромосомной патологии;
Вероятность врожденного порока развития (по результатам УЗИ);
Перенесенные ОРВИ, приём , профессиональные вредности, как негативные факторы, оказывающие влияние на ход беременности.
Как проходит приём у генетика?
Пациенту, пришедшему на консультацию, необходимо будет пройти через несколько этапов:
Уточнение диагноза. Если имеется подозрение на наследственную патологию, то врач будет использовать различные методы исследования, чтобы это подозрение опровергнуть или подтвердить: биохимические, иммунологические, цитогенетические, генеалогические и пр. Кроме того, потребуется изучение семейного анамнеза, выявление данных об имеющихся у ближайших родственников патологиях. Возможно, что потребуется более тщательное обследование больных родственников.
Прогноз. На этом этапе врач разъяснит обратившейся за помощью семье природу выявленного заболевания. Непосредственно прогноз строится на основе определенного типа наследования – моногенный, хромосомный, мультифакторный.
Заключение выдается пациентам в письменной форме, где указан прогноз здоровья для потомства конкретной семьи. Врач оценивает риски появления больного ребенка и информирует об этом супругов.
Рекомендации генетика сводятся к тому, что он даёт совет, стоит ли семье планировать рождение ребенка с учетом тяжести болезни, продолжительности жизни и возможных рисков, как для здоровья малыша, так и для здоровья родителей. Что касается решения и том, рожать ребенка или нет, то его будут принимать супруги самостоятельно.

Генетики в своей работе используют разнообразные сложные методы, позволяющие диагностировать возможные нарушения.
Среди них:
Генеалогический метод, который направлен на сбор информации о заболеваниях родственников в нескольких поколениях.
HLA-тестирование или исследование генетической совместимости. Этот метод диагностики рекомендован к прохождению супругам во время планирования будущей беременности . Кроме того, возможно исследование кариотипов мужа и жены, анализ полиморфизмов генов.
Преимплационное изучение генетических отклонений в развитии эмбрионов, которые были получены при ЭКО.
Неинвазивный комбинированный скрининг сывороточных маркеров женщины и плода. Это метод выполняется на этапе вынашивания ребенка и позволяет выявить имеющиеся хромосомные патологии.
Инвазивные методы диагностики плода применяют только при условии острой необходимости. Генетический плодный материал получают с помощью биопсии хориона, кордоцентеза или амниоцентеза.
УЗИ плода также является довольно информативным методом и позволяет увидеть грубые дефекты и аномалии развития плода. Его выполняют в обязательном порядке три раза за время вынашивания ребенка.
Биохимический скрининг – обязательная процедура для всех без исключения женщин, вынашивающих ребенка. Этот метод позволяет исключить многие хромосомные аномалии, как-то: синдром Патау, синдром Эдвардса и пр.
Скрининг новорожденных выполняется на предмет выявления муковисцидоза, галактоземии, фенилкетонурии, гипотиреоза врожденного, андрогенитального синдрома. Если маркеры к данным болезням обнаруживаются, то ребенка направляют к генетику, и он повторяет процедуру обследования. При подтверждении диагноза, врачом назначается соответствующее лечение.
Кроме вышеперечисленных методик, генетик способен установить отцовство и материнство, а также биологическое родство.
Профилактика наследственных болезней
Для профилактических целей в генетике имеются три направления:
Профилактика первичная. Она сводится к планированию деторождения, отказ от него при наличии высоких рисков развития патологии, а также к улучшению окружающей среды человека.
Вторичная профилактика сводится к отбору эмбрионов с дефектами на предимплантационном этапе. Кроме того, сюда входит прерывание беременности, если обнаруживается явная патология.
Третичная профилактика направлена на коррекцию тех проявлений, которые дают поврежденные генотипы.
Когда ребенок появляется на свет с уже имеющимися дефектами, то чаще всего ему требуется хирургическое вмешательство (при врожденных пороках). Социальная поддержка и соответствующая терапия, а также пожизненное наблюдение у генетика необходимы при генных и хромосомных аномалиях.
Что входит в компетенцию врача Генетика
1. Установление, по возможности, точного диагноза.2. Определение типа наследования в данной семье. Рассматривают минимум три поколения.
3. Расчёт вероятности риска повторения заболевания.
4. Определение эффективного способа профилактики.
5. Объяснение всего обратившейся семье.
6. Обследование включает: особые биохимические анализы, определение хромосомного набора (для исключения, например, болезни Дауна), ДНК-диагностику и многое другое.
Какими заболеваниями занимается Генетик
- Адреногенитальный синдром;- Аксиомы медицинской генетики;
- Болезни с аутосомно-доминантным типом наследования;
- Болезни с аутосомно-рецессивным типом наследования;
- Болезни с Х-сцепленным доминантным типом наследования;
- Генетика человека. Медицинская генетика. Клиническая генетика.
- Генетическая классификация наследственных болезней;
- Геномика;
- Геномика патогенных бактерий и вирусов;
- Евгеника;
- Значение генетики для медицины;
- Клиническая диагностика наследственных болезней;
- Микроцитогенетические синдромы;
- Миодистрофия Дюшенна-Беккера;
- Миотоническая дистрофия (болезнь Штейнерта, дистрофическая миотония);
- Митохондриальная наследственность;
- Муковисцидоз;
- Мутации;
- Наследственная предрасположенность к алкоголизму;
- Наследственность;
- Нейрофиброматоз 1-го типа;
- Особенности клиники наследственной патологии;
- Семейная гиперхолестеринемия;
- Синдром Вольфа-Хиршхорна;
- Синдром Дауна (трисомия 21);
- Синдром дисомии по Y-хромосоме;
- Синдром Клайнфелтера;
- Синдром кошачьего крика;
- Синдром Марфана;
- Синдром Патау (трисомия 13);
- Синдром трипло-Х (47, XXX);
- Синдром умственной отсталости с ломкой Х-хромосомой;
- Синдром частичной трисомии по короткому плечу хромосомы 9;
- Синдром Шерешевского-Тёрнера;
- Синдром Эдвардса (трисомия 18);
- Синдром Элерса-Данло;
- Составление родословной;
- Трисомия 8;
- Факторы повышенного риска рождения детей с хромосомными болезнями;
- Фармакогенетика;
- Фенилкетонурия.
Какими органами занимается врач Генетик
Генетик не лечит отдельные органы . Он устанавливает генетическую природу болезни. Обращаться к генетику, если:Имеет принципиальное значение вопрос пола ребенка;
Уже рождался ребенок с генетическими отклонениями;
В семье по линии одного из супругов были наследственные болезни или пороки развития;
Брак кровнородственный;
Матери больше 35 лет;
В прошлом были самопроизвольные выкидыши, бесплодие, мертворождения;
В ранние сроки беременности мать принимала лекарства, проходила химиотерапию либо подвергалась воздействию вредных факторов окружающей среды (радиация, химикаты).
Когда и какие анализы нужно делать
Определение мутантного гена ответственного за данное заболевание.Какие основные виды диагностик обычно проводит Генетик
Диагностика проводится в каждом из конкретных случаев заболевания. Наиболее благоприятное время для зачатия ребенка конец лета - начало осени. Пребывание на свежем воздухе, употребление продуктов богатых на витамины, солнце, отсутствие вирусных инфекций - все это благоприятно влияет на рождение здорового ребенка.Делая карьеру, не надо забывать, что женщина находится в наилучшей форме для рождения здоровых детей от 18 до 35 лет.
Если же беременность наступила после 35 лет необходимо пройти генетическое обследование.
Очень важно сохранение любой информации, касающейся истории здоровья каждой семьи. Большинство будущих родителей имеет небольшой риск передачи каких-либо генетических дефектов и никогда не пользуется услугами специалиста-генетика. Во многих случаях акушер в разговоре с каждой из таких пар затрагивает основные генетические проблемы.
Самый лучший период для встречи с генетиком, конечно, время до начала беременности или, в случае близкого родства, еще до заключения брака. Если же женщина уже беременна, генетик предложит провести соответствующие пренатальные тесты и поможет родителям принять решение, иметь им детей или нет. Советы генетика спасли сотни тысяч пар с высоким риском рождения детей, пораженных серьезными пороками развития.
Акции и специальные предложения
Медицинские новости
Ученые из Колорадского университета в США заставили раковые клетки быть более восприимчивым к лекарственным препаратам . Пораженным клеткам необходим...
В Санкт-Петербурге состоялось занятие практической школы по лечебной физкультуре для пациентов с болезнью Бехтерева. В мероприятии приняли участие около 25 пациентов, страдающих этим тяжелым ревматическим заболеванием
Генетик - врач, изучающий заболевания, передающиеся по наследству. Этого специалиста советуется посетить всем парам, планирующим иметь детей, а также женщинам во время беременности, особенно когда существует риск рождения малыша с патологией.
Некоторые недоумевают, что делает генетик при беременности, протекающей, на первый взгляд, гладко; зачем же тогда консультироваться у него? Дело в том, что часто дети с генетическими отклонениями рождаются у вполне здоровых родителей, которые являются лишь носителями поврежденных хромосом или мутаций. Они могут и не догадываться о такой проблеме. Чтобы избежать подобной плачевной участи, как раз и обращаются в генетические центры.
В каких ситуациях идут к генетику?
Консультируются у этого специалиста в следующих ситуациях:
- обследование перед вступлением в брак с целью создать здоровое потомство;
- планирование беременности;
- бесплодие или случаи выкидышей, мертворожденных;
- в предыдущий раз уже рождался младенец с генетическими патологиями;
- передающиеся по наследству болезни имеются у других членов семьи;
- во время вынашивания ребенка для установления риска гестоза, задержки в развитии, тромбофилии; особенно это актуально при изменениях на;
- у кого-то из членов семьи есть проблемы с физическим или психическим развитием (низкий рост, аутичное поведение, скелетные деформации);
- онкология у близких родственников;
- для установления отцовства (когда младенец внешне не похож на членов семьи);
- случаи, когда будущие родители - кровные родственники;
- беременная женщина возрастом моложе 18 лет или старше 35;
- во время вынашивания ребенка женщина перенесла инфекционное заболевание или был рецидив хронического, при котором принимались лекарственные средства;
- будущая мама употребляет алкоголь, наркотики, делала рентгенодиагностику, находясь в положении.
Болезни, которыми занимается генетик
Вот лишь некоторые заболевания, диагностика которых возможна после генетических исследований:
- муковисцидоз;
- адреногенитальный синдром;
- нейрофиброматоз I типа;
- синдром Дауна;
- синдром Марфана;
- синдром Патау;
- умственная отсталость с ломкой X-хромосомой.
Что делает врач генетик на приеме?
Он подробно расспрашивает пару о «семейных» болезнях, то есть, имеются ли сахарный диабет , заболевания сердца и тому подобное у ближайших родственников: родителей, бабушек, дедушек, братьев или сестер. В подобных ситуациях рассматриваются три поколения. Генетик изучает вашу карту с историей болезни. На основании собранной информации врач может назначить некоторые анализы, чтобы определить возможный риск. Генетик расшифровывает результаты скринингов, сделанных на любом сроке беременности.
Какие анализы и методы диагностики применяются?
Когда на основании собранных данных о родственниках мужа и жены генетический риск составил до 5%, он рассматривается как низкий; от 6 до 20% - средний. При нем паре рекомендуют пройти один из методов пренатальной диагностики. Если риск составил больше 20%, дальнейшее обследование происходит в обязательном порядке.
Пренатальная диагностика
Неинвазивные методы (без хирургического вмешательства). К ним относят:
- . Многие пороки можно определить в конце I, в начале II триместра беременности. Например, такие: грыжи передней брюшной стенки, спинномозговые и черепно-мозговые грыжи, обширные пороки головного мозга, поликистоз почек, неразделившиеся плоды. Ввиду важности получаемой информации, нельзя пренебрегать ультразвуковым исследованием и делать его следует в назначенный доктором срок. Обычно процедура проводится трижды на 11-12, 20-22, и 30-32 неделях. Если есть показания, делают с интервалом в 4 недели. Врачи давно установили определенную зависимость между характером порока и временем его обнаружения на.
- Получение альфа-протеина , продуцируемого из плаценты, и других маркеров, фрагменты ДНК которых обнаруживаются в крови женщины. Их определяют на 16-20 неделе. Если содержание этого вещества отклоняется от нормы, можно предположительно говорить о риске развития порока нервной системы у плода или риске хромосомной патологии.
Инвазивные методы (с хирургическим вмешательством). С их помощью выделяют клетки плода для исследований. Подобные методы дают достаточно точные результаты о состоянии плода, но существует угроза прерывания беременности вследствие хирургического вмешательства, поэтому к их проведению прибегают в крайних случаях, когда риск развития пороков высок. К инвазивным методам относятся:
- Амниоцентез (забор, а также анализ околоплодных вод). Наиболее распространенный метод исследования. Проводится на сроке 17-20 недель. Благодаря такому исследованию определяется кариотип плода, содержание определенных ферментов и гормонов, альфа-протеина; производится анализ ДНК на предмет хромосомной патологии.
- Кордоцентез. Это забор крови плода из пуповинных сосудов. Он также проводится лишь с 17 недели беременности. Таким образом определяются болезни крови, иммунодефицитные состояния, передающиеся по наследству, внутриутробное инфицирование плода, нарушения обмена веществ, выявляется кариотип.
- Биопсия хориона . Забор делается посредством прокола передней брюшной стенки и плодного пузыря. Процедура проводится на сроке от 8 до 11 недель. Она показана, когда у одного из родителей изменен кариотип (хромосомный набор) или в семье уже есть ребенок с наследственными патологиями.
- Эмбриоскопия. Исследование, проводимое в I триместре. Специальная гибкая оптика вводится в шейку матки для непосредственного наблюдения и оценки кровообращения эмбриона изнутри. Эмбриоскопия делается не раньше срока 5 недель.
- Биопсия кожи плода. Проводится для диагностики некоторых кожных заболеваний.
Что такое анализ кариотипа?
Это исследование числа имеющихся хромосом, их формы и размеров. Приблизительно через 1-2 недели после сдачи анализа результаты будут готовы. Если все в порядке, то 46 хромосом сгруппированы и обозначаются как 46XY для мужчин и 46XX для женщин. В случае присутствия патологических изменений, хромосомный набор может быть больше или меньше 46, парные соединения могут быть нарушены или неверно сгруппированы. Такие изменения называются анеуплоидии.
Безусловно, обследование у генетика играет большую роль: оно позволяет заглянуть во внутриутробное развитие плода, сделать определенные прогнозы. Однако существует морально-этический аспект таких анализов: если, например, во время такого обследования будущим родителям сообщают, что у ребенка синдром Дауна, как быть? Ведь генетик не лечит наследственные болезни, а лишь выявляет их.
Часто в подобных случаях матери предлагают прервать беременность, однако, считается, что с момента зачатия внутри развивается жизнь, имеющая право на существование. Кроме того, бывают случаи, когда рассчитывается лишь вероятность риска развития той или иной болезни. Но это не значит, что она обязательно проявится.
Генетик - врач, основной задачей которого является выявление и лечение заболеваний, развивающихся вследствие различных генетических нарушений. На прием к этому специалисту следует идти, если у кого-то из членов семьи уже точно установлено или подозревается развитие наследственной патологии. К генетику нужно обращаться родителям, у которых родился ребенок с физическими либо умственными нарушениями, а также парам в период планирования беременности для того, чтобы предотвратить возможные проблемы.
Что входит в обязанности врача генетика
Генетик в самую первую очередь должен точно поставить диагноз. Затем ему следует выявить тип наследования в каждом конкретном случае. В его обязанности входит и расчет вероятности риска рецидива того или иного недуга. Именно данный специалист может определить на все сто процентов, смогут или не смогут меры профилактики помочь предотвратить развитие наследственного заболевания. Он также должен четко объяснить все свои размышления больному, а также членам его семьи, если таковые имеются у него на приеме. Ну, и, конечно же, именно это специалист должен провести в случае необходимости все необходимые обследования.
В каких случаях прием у врача генетика является обязательным
Если для семейной пары имеет особое значение пол ребенка, тогда им стоит посетить генетика. То же самое стоит сделать и всем тем семьям, у которых в роду были либо есть наследственные заболевания или уродства. Наличие в семье ребенка с генетическими отклонениями – это еще один повод записать на прием к данному врачу. Без помощи данного специалиста не обойтись и в случае кровнородственных браков, а также, если женщина забеременела в возрасте старше тридцати пяти лет.
Когда следует обращаться к Генетику
Следует обращаться к генетику, если:
- имеет принципиальное значение вопрос пола ребенка;
- уже рождался ребенок с генетическими отклонениями;
- в семье по линии одного из супругов были наследственные болезни или пороки развития;
- брак кровнородственный;
- матери больше 35 лет;
- в прошлом были самопроизвольные выкидыши, бесплодие, мертворождения;
- в ранние сроки беременности мать принимала лекарства, проходила химиотерапию либо подвергалась воздействию вредных факторов окружающей среды (радиация, химикаты).
Перечень стандартных обследований пациентов с гематологическими заболеваниями.
Заведующий лабораторией функциональной геномики Медико-генетического научного центра Михаил Скоблов рассказал, к чему в итоге приведут исследования в области медицинской генетики и почему первый «отредактированный» человек, скорее всего, родится в Китае.
Начну с того, что коротко расскажу о себе. Я больше десяти лет работаю в Медико-генетическом научном центре, который занимается генетическими заболеваниями человека - тем, как они устроены, каковы их причины - и разрабатывает разные подходы для их диагностики и лечения. Также я работаю в Московском физико-техническом институте, где созданы хорошие условия для занятий наукой. В МФТИ меня в первую очередь интересуют студенты - талантливые ребята, которые уже сейчас могут стать участниками научного процесса, в частности, помогать обрабатывать огромное количество данных, продолжающих накапливаться в области биологии и медицинской генетики.
А что же это такое - медицинская генетика? Одно из простых объяснений: это наука, занимающаяся выяснением роли генов в возникновении патологий у человека. Как известно из школьного курса, вся генетика пошла от Менделя (Грегор Иоганн Мендель - австрийский ботаник, монах-августинец, основоположник учения о наследственности. - Р ед. ); так вот, те же самые классические законы наследования, им прописанные, лежат и в основе современной медицинской генетики.
Начнем с наследственных болезней. Я расскажу, как их находили, как описывали, как изучали. Вообще это довольно сложный вопрос. Вычленить генетические заболевания долгое время не удавалось. Это совсем не простая задача. Но основным краеугольным камнем в медицинской генетике является понимание наследования заболеваний. И в основе этого лежит так называемая родословная семьи больного.

Квадратиками в таких «родословных» всегда обозначаются лица мужского пола, кружочками - лица женского пола. Вот у них образуются дети, которые тоже могут давать потомство, и так далее. И вот в каком-то поколении возникает один больной член семьи, и понятно, что его болезнь может как-то наследоваться. И тут возникает та самая генетическая компонента, которую можно вычленить, расписать, с ней медицинская генетика уже может начинать работать.
Самое первое вычленение генетической компоненты случилось относительно недавно - в 1966 году. Был такой ученый Виктор Алмон Маккьюсик, который создал каталог аутосомно-доминантных, аутосомно-рецессивных и Х-сцепленных фенотипов (то есть то, как люди выглядят, как в них проявляются заболевания). И с тех пор весь мир занимается исследованиями и сбором информации о том, как выглядят генетические заболевания, как они устроены. На сегодняшний день их описано очень много - больше восьми тысяч. Существует онлайн-база данных OMIM (Online Mendelian Inheritance in Man) , в которой любой ученый, если он провел грамотное исследование, может оставить запись, тем самым обогатив науку.

Какие-то заболевания известны очень хорошо - мы знаем их молекулярные основы и понимаем, из чего они происходят. Для каких-то вcе еще не хватает информации. А про какие-то болезни пока только предполагается, что они могут быть генетическими. Но это самая важная основа медицинской генетики: мы имеем описания заболеваний, которые на сегодняшний день удалось сделать, и их теперь можно исследовать.
В целом моногенные болезни - то есть когда поломки в каком-то гене приводят к заболеванию - проявляются в раннем детском возрасте. Большая их часть - почти 90% - диагностируются в младенчестве. Менее 10% проявляется после полового созревания и только 1% - в конце репродуктивного периода. Логика понятна: если происходит какая-то поломка в генетическом материале, перестает функционировать какой-то белок, то, как правило, проявления этой поломки видны с первых дней жизни, а очень часто даже внутриутробно. Но если все-все заболевания сложить, то - в случае моногенных заболеваний, когда поломка в одном гене приводит к одному заболеванию, - частота их проявлений составляет 0,36%. Скажу иначе: из тысячи человек только четырем грозит быть обладателями генетического заболевания. Но все эти болезни исследуются самым подробным образом. Что это за болезни? В России наиболее часто встречающимися являются следующие:

Для муковисцидоза: один больной встречается на восемь тысяч человек. Для фенилкетонурии: один на десять тысяч. То есть самое частое заболевание - оно же и редкое. Но суммарно мы имеем достаточно большую цифру.

У каждого из нас есть два набора хромосом: одни пришли от папы, другие от мамы. В случае аутосомно-рецессивного заболевания каждый из родителей может нести поломки гена в одной хромосоме - одна поломка в маминой, другая в папиной. Соответственно, когда у них рождаются дети, то возможны три варианта: рождается больной ребенок, у которого поломки двух копий генов, рождается двое детей, и у каждого по одной поломке, или ребенок, у которого нет ни одной поломанной копии гена. То есть в случае аутосомно-рецессивного заболевания в потомстве только один ребенок может иметь обе копии поломанных генов, в результате чего и возникает заболевание. Считается, что в среднем в популяции каждый из нас может быть носителем восьми или даже десяти мутантных аллелей (то есть разных форм одного и того же гена). То есть мы можем (не дай бог, конечно) встретить партнера, у которого будет поломка в том же самом гене, и это приведет к тому, что будут рождаться дети по вот такому распределению. Аутосомно-рецессивный тип наследования встречается почти у половины всех генетических заболеваний человека.

Второй вариант - аутосомно-доминантный тип наследования. Здесь картина еще проще: достаточно поломки лишь в одной копии гена, и возникает заболевание. Поэтому если мы имеем одного больного родителя, то это заболевание будет четко наследоваться с 50-процентной вероятностью его детьми. Почему здесь одно наследование, а там другое? Ну, вот так устроены гены. Иногда ген настолько важный, что его недостаток приводит к тому, что заболевание возникает. А бывает, что у детей или у самих родителей половина копий генов нормальная, половина с мутацией, но срабатывает компенсаторный механизм, который помогает организму с этим справляться, и заболевание никак не развивается.
Откуда берутся эти самые поломанные гены с этими самыми мутациями? Понятно, что мы имеем в своих клетках ДНК, и ДНК эта очень-очень большая. Три миллиарда нуклеотидов! Соответственно, когда клетки делятся, как бы ни был точен процесс деления, возникают ошибки. Несмотря на то что у нас в клетках существуют механизмы, которые смотрят за тем, чтобы ошибок не было, и даже репарируют неправильные замены, - все равно какая-то часть мутаций возникает и наследуется. И долгое время было непонятно: а как же часто это происходит, как это все устроено? И лишь недавно - буквально в последние несколько лет - вышло несколько очень мощных научных работ. Геномы здоровых и больных людей полностью секвенировали, чтобы возможно было оценить, как возникают новые мутации относительно первого поколения и второго, и оказалось, что в среднем от отца дети наследуют около сорока каких-то новых изменений. То есть в геноме отца этих изменений нет, а у ребенка они появляются. И, что самое интересное, в тех же работах показано: чем старше отец, тем больше в его ДНК поломок передается потомству. К женщинам это, кстати, не относится. В среднем от матери ребенку передается порядка десяти-двадцати замен, но это число не зависит от возраста матери. Повторю еще раз. Смысл в том, что если мы возьмем двух абсолютно здоровых людей и у них родится ребенок, то у малыша будет примерно сорок новых замен от папы и двадцать новых замен от мамы, то есть он будет иметь порядка шестидесяти замен в геноме, которых у родителей нет. И понятно, что эти шестьдесят изменений могу находиться в любом месте. Они могут быть в каких-то важных генах, а могут быть в генах, которые вообще не имеют никакого смысла. Но вероятность того, что изменения эти все же могут повредить какой-то ген и возникнет заболевание аутосомно-рецессивного типа или аутосомно-доминантного, есть всегда. И с этим мы вообще ничего сделать не можем - так устроена природа. И она при этом все-таки довольно совершенна. Вы только представьте: три миллиарда нуклеотидов удваиваются при делении клетки, и это все довольно сложный, большой процесс, и только сорок ошибок могут при этом возникнуть. Заболевания эти всегда были, есть и будут, и человечеству от них не избавиться. Но что самое важное - и это то, чем медицинская генетика занимается, на что направлена, - теперь у нас есть ДНК-диагностика.

Зачем диагностируют генетические заболевания? В первую очередь, для того, чтобы человек понимал свою судьбу. Когда человек чем-то болен, знание и само понимание природы этого заболевания - как оно устроено, почему возникло - психологически сильно облегчают жизнь. Второй и зачастую самый важный момент: ДНК-диагностика нужна для того, чтобы, воспользовавшись знанием, люди могли запланировать рождение здоровых детей. И сейчас я расскажу про то, как это устроено.
Генетических заболеваний много, и причин, по которым они возникают, тоже много. Самые первые исследования этих причин выглядели очень просто: все, что могли сделать ученые 50-60 лет назад, - это посмотреть в микроскоп и увидеть, как устроены хромосомы человека. И сегодня мы знаем, что у человека 23 пары хромосомы. Все возникающие аномалии относительно этой нормы ученые регистрируют, и описывают, и связывают с какими-то генетическими заболеваниями. Вот картинка, в которой несложно разобраться, если внимательно посмотреть, что же такого в ней неправильного.

Легко заметить, что у 21-й хромосомы три копии вместо положенных двух. Не заметить это в микроскоп даже студенту сложно. И понятно, что такое вот аномальное увеличение копий хромосом - как и, наоборот, уменьшение - приводит к заболеванию. То же самое, если хромосома имеет какую-то чрезмерную длину или становится короче. И отсюда возникают хромосомные заболевания. Они представляют собой очень большую группу - около 1% новорожденных имеет такие патологии (и около 2% детей рождается с хромосомными патологиями у женщин старше 35 лет; безусловно - так уж устроена биология - с возрастом некоторые процессы начинают работать хуже, в том числе эмбриональное развитие и многое другое). Вообще статистика хромосомных аномалий очень интересным образом устроена. На 10 тысяч беременностей, которые статистически можно проанализировать, мы имеем порядка 9 тысяч с нормальными хромосомами и порядка 800 случаев с патологиями. И среди этих 800 - вот так уж опять устроена природа - лишь 50 случаев приводят к тому, что рождаются дети, имеющиеся какие-то аномальные вещи. Остальные беременности, как правило, замирают, не развиваются и заканчиваются самопроизвольными выкидышами. С одной стороны, это хорошо. Природа понимает, что должен быть нормальный набор хромосом, а если что-то не так - хромосом становится больше, меньше, теряются какие-то важные фрагменты, - на клеточном уровне запускаются процессы, которые беременность останавливают. С другой стороны, в каких-то случаях беременность продолжается, несмотря ни на что. Один из самых известных примеров - трисомия 21-й хромосомы, которая приводит к синдрому Дауна.
Конечно, на сегодняшний день существуют разные способы всего этого избежать. Микроскопический метод наблюдения за количеством и качеством хромосом, существующий очень давно и очень успешно, потихонечку вытесняется более современным и чувствительным методом, который называется «микроматричный анализ».

Я совсем кратко обрисую, как он устроен: берутся ДНК пациента и контрольная ДНК, хитрым образом готовятся, флуоресцентно метятся и на специальных матрицах гибридизуются, в результате мы видим хромосомы и видим флуоресцентный сигнал, который поступает от разных фрагментов ДНК больного. В каких-то случаях сигнал возрастает, и это означает, что в этом месте возникают копии генов, в каких-то, наоборот, пропадает, и это означает, что какой-то участок в гене был, но пропал. То есть в одном случае возникает дупликация, в другом - делеция. Микроматричный анализ очень чувствительный, и с помощью него происходящие события можно разглядеть с предельно высокой точностью.
Однако основным методом диагностики было и остается секвенирование ДНК. Оно было изобретено в 1980 году замечательным ученым Фредериком Сенгером, который придумал, как можно определять те самые нуклеотиды, из которых состоит наша ДНК. На сегодняшний день такого рода анализ поставлен на поток, его делают практически во всех ДНК-диагностических лабораториях мира. Делается он очень быстро, эффективно, с помощью него можно исследовать отдельные участки генов. Грубо говоря, это основная машина медицинской генетики. Поиск мутаций генов с помощью секвенирования ДНК очень простой: на выходе мы получаем хроматограмму, где за каждым всплеском сигнала стоит какая-то конкретная буква. Когда мы секвенируем ДНК больного, то мы можем обнаружить, что у здорового человека в одном месте буква Т, а у больного в том же месте - буква Г. Найти мутации в каких-то конкретных генах - задача несложная. Главное - понимать, где эти мутации смотреть.

Следующий шаг развития ДНК-диагностики - массовое параллельное секвенирование. Изобретены такие мощные машины, которые могут отсеквенировать ваш геном весь и сразу, то есть все-все хромосомы, все-все гены за один анализ будут проанализированы и расшифрованы. Технология эта появилась относительно недавно и долгое время работала недостаточно качественно. Сегодня все ошибки устранены, и массовое параллельное секвенирование является одним из самых точных и доступных большинству людей анализов. Сделать его может каждый - стоит это порядка 30 тысяч рублей. Сейчас машины для секвенирования выглядят вот так:

Но самое интересное, что они, как ожидают (и правильно делают) ученые, будут в ближайшем будущем вытеснены совсем маленькими, очень компактными мини-секвенаторами, которые будут подключаться к USB -порту. На сегодняшний день эта технология тестируется - пока, правда, делает много ошибок, - но ожидается, что такой аппарат будет стоить всего-то около 200 долларов и будет выглядеть как-то так:

В какой-то мере очень даже хорошо, но в то же время и плохо. Появление таких технологий, способных к подобному роду анализов, привело к тому, что в развитых странах - в частности, в Англии и Нидерландах - бюджетные больницы сделали такой анализ обязательным для всех, кто к ним приходит. Причем неважно, имеет человек генетические заболевания или нет: как только он записался на прием к врачу, ему сразу делают секвенирование генома. Это было введено в 2011 году - то есть относительно недавно, - и сейчас клиник, практикующих такой подход, становится все больше. И все было бы прекрасно и здорово, но на руки врач получает разные буковки - A, Т, Г, Ц, которые могут следовать друг за другом в разном порядке, и количество этих буковок у каждого из нас - порядка трех миллиардов штук.

Самая сложная задача этого подхода (секвенирование генома и его последующий анализ) заключается в том, чтобы расшифровать смысл этой последовательности, интерпретировать ее, понять, где в ней есть мутации, которые вызывают заболевания или предрасположенность к ним, а где их нет. Как только люди научатся понимать эту расшифровку, «читать» эту аннотацию, так сразу начнется следующий этап развития медицинской генетики. Но пока этого не произошло, вряд ли будет полезным, если мини-секвенаторы, так сказать, войдут в наши дома.
Осознание этой проблемы началось вот с этих двух замечательных людей. В 2007 году вышли - параллельно и практически одновременно - две работы, в которых были просеквенированы персональные геномы Крейга Вентера и Джеймса Уотсона (да-да, того самого, который открыл двухцепочечную структуру ДНК, действительно великого ученого; в знак того, что он так много сделал для науки, ему был преподнесен вот такой подарок). В общем, вышли две эти работы по секвенированию индивидуальных геномов человека, в которых ученые пытались вычленить смысл из этой последовательности, и - ничего у них не получилось. Потому что при анализе были найдены гены, отвечающие за конкретный фенотип (цвет глаз, цвет волос) или ответственные за возникновение каких-то заболеваний, но по факту проявлений этих обнаружено не было. Или, наоборот, у Вентера и Уотсона были заболевания и разные физиологические состояния, но ничто в «аннотации» на них не указывало. Возникла пропасть. Вроде знаем буквы - A, Т, Г, Ц, но правильно интерпретировать их смысл не умеем. Пропасть эта имеется до сих пор. Почему? Потому что геном человека очень большой, и если мы просеквенируем ДНК любого из нас, то в результате получим около трех миллионов каких-то индивидуальных различий, которые будут отличать нас друг от друга. Что и было в свое время сделано с Вентером, Уотсоном и другими неизвестными людьми: когда их отсеквенировали, выяснилось, что 3,2 миллиона нуклеотидов отличают Уотсона от всех других. И разобраться, важны ли эти три миллиона и какие особенности важнее других, пока очень и очень сложно. Даже если брать не весь геном, не всю длинную последовательность ДНК, а рассматривать только значимые участки, где содержатся гены, из которых образуются белки, выполняющие какую-то функцию. Таких участков в геноме около одного процента. Суммарно во всех них содержится от 30 до 70 тысяч геномных различий. И разобраться, какие влияют на работу белка, а какие не влияют, с точки зрения медицинской генетики пока что является очень сложной задачей. Работа потихонечку движется, и опять-таки в этом помогает подход, который был обнаружен в самом начале медицинской генетики, - анализ родословной больного. Когда нет нужды сравнивать ДНК данного конкретного человека с ДНК других людей, а можно сравнить с ДНК родственников, то есть генетически близких индивидуумов. Вот ДНК здорового брата, а вот больного - какая разница есть между ними? В этом случае найти причину заболевания становится гораздо легче.
Подобные работы на сегодняшний день как раз являются самыми успешными. И вот одна из них: мальчик болел невропатией, просеквенировали геном родителей и геном мальчика и по разнице того, что есть у родителей, с тем новым, что нашли у ребенка, обнаружили мутацию в гене SLC26A3 , и стало понятно, откуда это заболевание, даже были предложены какие-то способы его компенсировать.

99% генетических заболеваний неизлечимы на сегодняшний день. Никак мы пока не можем помочь людям. И то, что медицинская генетика дает, - это лишь предупреждение заболеваний. Я тут составил такую широко известную шараду - «лечить нельзя предупредить», и сейчас мы проговорим все, что подходит под заголовок, который получится из шарады, если запятую поставить после второго слова. То есть - «лечить нельзя, предупредить». И как же предупреждают? Первый способ: ДНК-диагностика носительства мутаций. Вот интересный случай, который описывает, насколько этот метод эффективен и правилен. Есть такое генетическое заболевание Тея-Сакса - очень тяжелое, очень редкое. В возрасте около полугода у детей возникает остановка в психическом и физическом развитии, постепенно теряются зрение, слух, способность глотать, ребенок погибает в возрасте примерно четырех лет. Известно, что мутация, вызывающая это заболевание, находится в гене HEXA , что это аутосомно-рецессивный тип наследования, то есть оба родителя имеют по поломанной копии гена и ребенок наследует обе поломки. Так уж устроено наше существование, что в каких-то странах, которые живут обособленно и закрыто, такого рода заболевания встречаются очень часто. В общем, в случае Тея-Сакса это Израиль. И конкретно евреи-ашкеназы. Один больной ребенок на три тысячи новорожденных. Заболевание тяжелое, а Израиль - это государство, которое заботится о здоровье нации. Потому на государственном уровне было введено обязательное тестирование на носительство мутаций в гене HEXA , и буквально через несколько лет в Израиле стал рождаться лишь один больной ребенок на много сотен тысяч. Похожая история была в Финляндии, которая в последние 300 лет вела себя очень обособленно, не сильно взаимодействуя с миром, и это привело к тому, что отдельные генетические заболевания у финнов стали встречаться очень часто. У них тоже была введена скрининг-программа на носительство сразу нескольких болезней - и за весьма короткий срок их все активнейшим образом фактически элиминировали.

Несколько лет назад в России тоже запустили программу под названием «неонатальный скрининг». То есть, как только рождается ребенок, у него из пятки сразу берут несколько капелек крови и проводят ДНК-диагностику на самые частые в нашей стране генетические заболевания: адреногенитальный синдром, галактоземию, врожденный гипотиреоз, муковисцидоз, фенилкетонурию. Делается это все для того, чтобы на ранних этапах понять, как можно помочь человеку, максимально компенсировать патогенный эффект, не дать ему развиться.

Следующий вариант диагностики - пренатальная диагностика. На ранних сроках беременности аккуратно, не повредив ни плод, ни внутренние органы матери, берут кое-какие части хориона, то есть оболочки плода, по которым делают генетический анализ будущему ребенку, чтобы понять, несет ли он какие-то поломки в своих генах. Если выясняется, что поломки присутствуют, матери предоставляется выбор: прервать беременность или продолжить. Это очень важно - предлагается выбор. Именно так устроено генетическое консультирование: не существует никаких строгих правил, человек сам решает, как ему с этим существовать.

Благодаря появлению мощных секвенаторов теперь есть неинвазивная пренатальная диагностика. Устроена она очень интересно. На ранних сроках беременности - например, на сроке в десять недель - у матери берут кровь из вены. Известно, что в ходе развития плода какие-то его клетки отмирают, ДНК их крошится и попадает в кровоток матери. И если взять у матери кровь и воспользоваться мощным секвенатором, то с помощью специальных алгоритмов можно идентифицировать, какая ДНК материнская, а какая плода, и увидеть, есть ли в геноме плода какие-то замены, мутации. И если мутации есть, то матери опять же предоставляется выбор.

Венцом всех трудов генетиков на сегодня является так называемая преимплантационная генетическая диагностика. Она появилась совсем недавно, является самым сложным, самым трудоемким и самым дорогим диагностическим методом, но позволяет получить здорового на сто процентов ребенка в подавляющем большинстве случаев. Сразу оговорюсь, такая диагностика нужна лишь в тех случаях, когда в лабораторию приходит супружеская пара и говорит: вот у нас первый ребенок родился с таким-то генетическим заболеванием, но мы хотим, чтобы следующий обязательно был здоровым. Генетики проводят анализ всей семейной истории, вычленяют ген с конкретной мутацией и понимают, что нужно делать, чтобы этой мутации у будущего ребенка не было. Как это происходит? У женщины вызывают суперовуляцию, в результате которой получают какое-то количество яйцеклеток. После этого в лабораторных условиях проводится экстракорпоральное оплодотворение. Спустя несколько дней из оплодотворенных яйцеклеток без какого бы то ни было урона для будущего эмбриона отбирают одну-единственную клетку, по которой проводят генетическую диагностику. И если удается получить информацию о том, что у данной оплодотворенной яйцеклетки на стадии бластомера не содержится никаких мутаций, то именно эта яйцеклетка подсаживается матери, которая через девять месяцев даст совершенно здоровое потомство.
Медицинская генетика разработала много разных подходов, позволяющих создать условия, в которых возможно избежать возникновения генетических заболеваний, но, конечно же, в случае новых мутаций, приводящих к возникновению наследственных заболеваний, мы не можем ничего прогнозировать. В результате рождаются больные дети. И понимание того, что их надо лечить (раз уже не смогли предупредить), - это очень и очень актуальная задача. И наука движется и в эту сторону тоже. Главная проблема состоит в том, что речь идет о восьми тысячах заболеваний. Разработать какой-то универсальный подход, который позволил бы в любом случае вылечить все, невозможно даже чисто теоретически. Поэтому для каждого случая генетики изобретают индивидуальные решения, индивидуальные технологии.

Вот здесь приведена диаграмма, на которой указаны самые разные терапевтические стратегии, применяющиеся для попыток лечения генетических заболеваний обмена веществ. Видно, что в каких-то случаях применяют хирургию, в каких-то - тканевую трансплантацию или трансплантацию костного мозга. Один процент занимает генная терапия, когда осуществляется доставка здоровой копии гена. В каких-то случаях пытаются ограничивать болезнь диетой или приемом лекарственных препаратов. В общем, подходов много.
Что касается диеты, то в некоторых случаях она устраняет заболевание практически полностью. Два широко известных заболевания - галактоземия и фенилкетонурия. Первое - это нарушение углеводного обмена, когда фермент, который усваивает молочный сахар, мутировав, перестает его расщеплять. Но когда рождается ребенок, он, понятно, питается исключительно материнским молоком. И в этом случае неусваивание молока потихонечку приводит к тому, что начинают развиваться разные патологии - в частности, желудочно-кишечные проблемы, цирроз печени, катаракты. Все это происходит буквально в течение первых недель и, к сожалению, довольно часто приводит к летальному исходу. Тем временем всего лишь посредством удаления молока из рациона ребенка можно сделать так, что это врожденное генетическое заболевание не будет проявляться. То же самое с фенилкетонурией - заболеванием, которое входит в пренатальный скрининг в России. Фермент, ответственный за метаболизм аминокислоты фенилаланина, мутировав, перестает работать. Но если убрать из пищи продукты, которые содержат этот самый фенилаланин (в том числе некоторые орехи, грибы, некоторые молочные продукты), ребенок будет развиваться здоровым. Однако таких историй про диеты совсем немного, по пальцам перечесть. Ученые пытаются для каждого больного подобрать питание, чтобы как-то облегчить его существование. Но все заболевания разные, и мутации не всегда приводят к тому, что ген сломался и больше не работает. Иногда функция белка сломана частично и он работает не так эффективно, поэтому достаточно что-то где-то слегка компенсировать - и эффект значительный.
Вероятно, что именно в Китае будет сделан - если уже не сделан кулуарно, что тоже все обсуждают, - «отредактированный» человек.
В целом способы терапии наследственных заболеваний можно разбить на две группы. Первая - за счет низкомолекулярных соединений, когда можно подобрать какую-то таблетку, которая скомпенсирует существующие поломки. Несмотря на то что мы все привыкли пить таблетки, в случае с наследственными заболеваниями это очень редко работает. А вот то, что должно чисто теоретически всегда работать - и в случае с генетическими поломками в первую очередь, - это использование разных молекулярных методов, куда сейчас и движется вся медицинская генетика. Самое интересное, что для того, чтобы использовать все эти подходы, существует целый арсенал разных вариантов. Есть методы, которые позволяют активировать работу каких-то конкретных генов: ген не работает, и мы можем сделать так, чтобы он в данной клетке активно заработал. Или, наоборот, работает мутантный ген, производит токсичные продукты, но существуют подходы, которые могут подавить его работу селективно, направленно, чтобы именно он среди всего генного многообразия перестал работать.
Самое последнее и интересное, что родилось в генетике буквально пять лет назад, - это редактирование мутантной копии гена. Подходы, которые позволяют исправить мутацию. Я расскажу об этом и о том, куда это все движется, но сперва напомню постулат, который всем нам, по идее, известен, - центральную догму молекулярной биологии. Помните, я рассказывал о великом ученом Джеймсе Уотсоне? Так вот, у него был друг - Фрэнсис Крик, с которым они вместе открыли двухцепочечную структуру ДНК. Потом Уотсон стал заниматься одними вещами, а Крик - другими (хотя оба работали в области молекулярной биологии). Но так или иначе именно Крик сформировал на основе структуры молекулы ДНК эту самую центральную догму: у нас есть ДНК, с нее получается РНК, с нее получается белок, являющийся венцом всей этой истории, который дальше как-то функционирует, выполняет какие-то функции. На сегодняшний день описано огромное множество белков, объяснено, как они устроены, какие у них есть части, отвечающие за функционирование. Для чего все это описывается? Для того, чтобы потом построить вот такую огромную генную сеть.


Мы понимаем, какие процессы с какими генами связаны, как эти процессы запускаются, как передаются сигналы из одного места в другое, как они регулируется. Мы понимаем, как применять все эти подходы, чтобы какой-то ген выключить, а какой-то включить. То есть, если возникла мутация в гене, это не значит, что все, конец, мы не можем ничего сделать. Нет, мы можем понять, какой обходной путь активировать, чтобы наладить нормальное существование клетки, нормальный метаболизм. Или - наоборот - какой путь подавить. И фундаментальная наука здесь очень нужна для того, чтобы эти знания дальше можно было использовать в генетике для лечения наследственных заболеваний. Но почему так сложно бывает применять эти подходы? Потому что человек - это многоклеточный организм. То, каким вы меня сейчас видите, - это миллиарды клеток, у каждой своя программа, и все занимаются какими-то своими функциями. В мозгу одни клетки, в мышцах другие. И это все очень сложно устроено, поэтому, если я намерен вмешаться в какой-то процесс, мне будет необходимо добраться не до всего организма в целом, а именно до тех клеток, которые реализуют конкретный фенотип. Если больной страдает от судорог, значит, в нейронах происходит плохая передача сигналов, и мне нет необходимости вмешиваться в работу всех клеток, мне нужно добраться до клеток мозга. Соответственно адресная доставка - самая сложная задача, стоящая сегодня перед учеными. Она легко реализуется, когда есть какой-то конкретный орган, хорошо изолированный, куда можно все доставить без каких-либо проблем. Самый простой пример - это глаз. Так уж заведено природой, что вот он, такой доступный, такой изолированный - и делай с ним что угодно. И довольно много чего с ним уже делают - в том числе применяют генную терапию, когда можно какие-то процессы подкрутить или, наоборот, подавить. Но есть и другой хорошо доступный орган - кожа. Казалось бы, вот она, но - не получается доставить туда материалы, потому что кожа имеет защитный барьер, не позволяющий, чтобы туда попадала всякая ерунда.
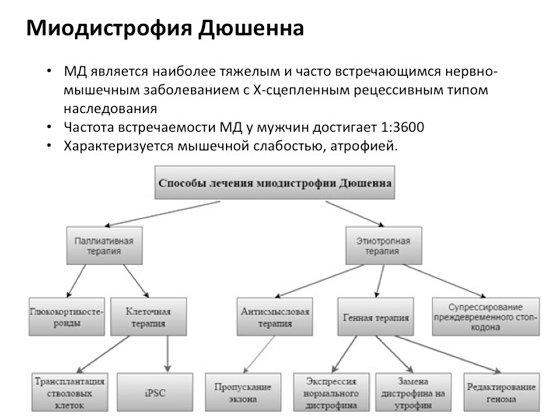
Есть, к примеру, такое заболевание - миодистрофия Дюшенна, очень распространенное. Чтобы его лечить, ученые разрабатывают разного рода подходы. И видите, тут не один подход, над которым ученые работают в течение многих лет, а много подходов. Где-то пробуют клеточную терапию - больному доставляют новые клетки, чтобы понять, будет ему лучше или не будет. Где-то добавляют разные лекарственные соединения. У кого-то получается лучше, у кого-то не получается совсем. Один из последних вариантов: ученые разработали специальное химическое вещество, которое позволяет избегать мутаций, вызывающих появление так называемых стоп-кодонов. Что это такое? В каких-то случаях мутация приводит к тому, что рибосома, когда двигается по РНК и синтезирует белок, доходит до возникающего за счет мутации стоп-кодона, и в результате получается укороченный белок вместо нормального, большого. Укороченный белок не может нормально функционировать. И ученые придумали такое вещество, которое помогает рибосоме при движении по молекуле РНК перестать распознавать эти стоп-кодоны, в результате получается длинный продукт. Это, на самом деле, очень большое достижение - и произошло оно совсем недавно.
Однако, несмотря ни на что, основная история, на которую все очень рассчитывают, - это генная терапия. Когда мы можем копию гена, которая не несет никаких мутаций, каким-то образом доставить в клетку с мутантным геном. Для этого существует так называемый вирусный способ доставки. То есть те самые вирусы, от которых мы болеем, специальным образом модифицируют, убирают все ненужные компоненты, оставляют только структурную часть и используют как транспорт для доставки нормального гена человека. Идея эта придумана очень давно, и сегодня ее пытаются реализовать во многих странах одновременно. Несколько тысяч испытаний сейчас происходит во всем мире.

Под конец я вам расскажу несколько удачных историй. Первая связана с заболеванием, которое называется синдромом дефицита аденозиндезаминазы. Возможно, вы слышали о фильме «Мальчик из пузыря» (или даже смотрели его) - про то, как жил-был мальчик, все время находился в пузыре, мама его ото всего оберегала, а он сбежал из дома и увидел, какой мир прекрасный. Эта история основана на реальных событиях. Мальчика звали Дэвид Веттер, у него было именно такое генетическое заболевание, связанное, по сути, с тяжелой формой иммунодефицита. Грубо говоря, ребенок мог погибнуть от любой инфекции. И когда стало понятно, что он так сильно болен, его изолировали от всего внешнего мира в комнатах, где он прожил довольно долго. Его все время пытались лечить разными методами, разными препаратами. У него была сестра, от которой ему делали пересадку костного мозга, - но и это не помогло. История, в общем, грустная: мальчик умер, не дожив немного до того момента, когда генная терапия была успешно применена к лечению этого заболевания. Выглядит это следующим образом: от больного берут клетки костного мозга, которые отвечают за производство иммунных клеток, с помощью вируса доставляют в них копию гена и затем клетки подсаживают обратно больному. В результате человек получает новый, так скажем, костный мозг с копией нормального гена. История эта была впервые реализована в 1990 году.
Еще одна история касается врожденного амавроза Лебера - это дегенерация сетчатки глаза, довольно редко встречающаяся и возникающая из-за мутации в определенном гене, кодирующем белок, который отвечает за пигментный эпителий сетчатки. Были разработаны специальные вирусные частицы, в которых была нормальная копия гена RPE65 , и больным, страдающим этим заболеванием, были сделали инъекции препарата прямо в глаз. В результате больные, потерявшие зрение или даже с рождения его не имевшие, вновь его обрели при лечении. В прошлом году этот генный препарат был одобрен специальным комитетом FDA , и его должны вот-вот запустить в массовое использование.
Таких историй немало, но наследственных заболеваний, как вы помните, очень много, около восьми тысяч.

Под конец, конечно, мне очень хочется хоть пару слов сказать о такой замечательной технологии, как редактирование генома. Она произвела полнейший фурор в науке. Суть этого редактирования в следующем: есть определенного рода белок, который обладает нуклеазной активностью, то есть может расщеплять ДНК, а за счет одной хитрой РНК мы можем программировать работу белка так, чтобы он разрывал ДНК в каком-то конкретном месте. А дальше возможны два варианта. Для нас сейчас важен один из них: когда белок разорвет ДНК в заранее запланированном месте, содержащем мутацию, можно активировать механизмы клеточной репарации, позволяющие разрыв восстановить так, что возникнет новая копия гена, которая не будет нести мутацию. И создание такого рода белков, которые специфично могут быть куда-то направлены, в какие-то определенные гены, - это очень важный шаг. И при этом очень простой и удобный метод: любой студент в хорошо оснащенной лаборатории может с этим справиться за считанные месяцы. Поэтому сейчас выходит много публикаций о том, где и когда эту технологию применяют, и понятно, что в первую очередь ее пытаются применить для лечения разных генетических заболеваний. И пока, судя по научным статьям, все идет хорошо. Я читал недавно статью в журнале Nature , в которой анализировалось, как в разных странах на сегодняшний день устроены законодательные акты и где впервые должен появиться «отредактированный» человек - неважно, с суперспособностями или просто вылеченный от какого-то заболевания. Если не вдаваться в подробности, то абсолютно все страны это не поддерживают. Но вопрос в том, насколько это глубоко проговорено на законодательном уровне. В общем, в статье говорится, что одна из потенциальных стран, в которой все эти моменты проговорены менее четко, - это Китай. Причем если раньше считалось, что Китай - отсталая в научном плане страна, то сейчас они нас обогнали так, что их уже и не догнать, особенно в биологии. Китайцы вкладывают в это огромное количество денег. Они привлекают специалистов со всего мира, своих посылают обучаться, а потом берут обратно и дают им лаборатории, институты. Они очень активно в этом направлении развиваются. Вероятно, именно в Китае будет сделан - если уже не сделан кулуарно, что тоже все обсуждают, - «отредактированный» человек. И самая первая история, которую долго не могли опубликовать, была про то, что уже демонстрировали метод редактирования генома на человеческих эмбрионах. Ничего страшно там не было, все очень хорошо и правильно было сделано, эмбрионы человека не могли размножаться дальше и были взяты как модельный объект. В общем, эксперимент показал, что при редактировании пока возникает много ошибок. Как это принято в научном сообществе, любая новость такого рода самым активным образом дискутируется: с одной стороны, все понимают - да, все эти технологии, что только что появились, годятся для решения разных задач. С другой стороны, побочные эффекты, которые могут появиться, никто не может предсказать. И потому ученые очень аккуратно, шаг за шагом делают попытки все это проверить и исследовать. Я очень не хочу зря обнадеживать, но, как мне кажется, в ближайшие десять-двадцать лет у нас точно появятся надежные средства для лечения с помощью генной терапии. А пока имеем то, что имеем.
Записала Наталья Кострова
> Генетик
Данная информация не может использоваться при самолечении!
Обязательно необходима консультация со специалистом!
Генетик - врач, основной задачей которого является выявление и лечение заболеваний, развивающихся вследствие различных генетических нарушений. На прием к этому специалисту следует идти, если у кого-то из членов семьи уже точно установлено или подозревается развитие наследственной патологии. К генетику нужно обращаться родителям, у которых родился ребенок с физическими либо умственными нарушениями, а также парам в период планирования беременности для того, чтобы предотвратить возможные проблемы.
Как генетик обследует своих пациентов?
Консультация врача включает в себя несколько этапов. Начинается прием с уточнения диагноза и изучения родословной пациента. Полученные при опросе сведения помогают врачу-генетику заподозрить возможность возникновения наследственной патологии и определить, по какому типу наследования она передается.
Далее генетик направляет человека на общее обследование для выявления и лечения уже имеющихся болезней различного характера. После того, как получены все данные о состоянии здоровья, специалист для подробного изучения наследственности назначает ряд необходимых генетических анализов: генетический скрининг, анализы на ломкую X-хромосому, кариотип, ДНК-диагностику. Данные этих исследований помогают достаточно точно определить возможность развития того или иного наследственного заболевания.
Значимость генетического обследования на этапе планирования беременности
Данные статистики неутешительны - около пяти процентов детей на планете рождаются сейчас с различными генетическими отклонениями. Консультация генетика на этапе планирования беременности является необходимой мерой предупреждения различных наследственных заболеваний у новорожденных. Попасть на прием к этому специалисту можно, получив направление в женской консультации либо у своего лечащего врача во время планового осмотра. Очень важно посетить генетика еще до зачатия, чтобы свести к минимуму риск рождения больного ребенка.
С врачами каких специальностей сотрудничает врач-генетик?
Наследственные заболевания поражают различные органы и системы человека, поэтому для выявления точных закономерностей их возникновения работа врача-генетика требует тесной связи со специалистами разных медицинских направлений (невропатологом, эндокринологом, педиатром, акушером и многими другими), так как исходной точкой для генетических исследований служит поставленный врачом-специалистом диагноз.
Спасибо
Записаться к Генетику
Кто такой генетик?
 Генетик
– это специалист, в чьи обязанности входит выявление, лечение и профилактика наследственных заболеваний. Также этот специалист занимается генетической предрасположенностью человека к тем или иным патологиям. Выражаясь простыми словами, этот доктор специализируется на проблемах со здоровьем, которые передаются ребенку от родителей.
Генетик
– это специалист, в чьи обязанности входит выявление, лечение и профилактика наследственных заболеваний. Также этот специалист занимается генетической предрасположенностью человека к тем или иным патологиям. Выражаясь простыми словами, этот доктор специализируется на проблемах со здоровьем, которые передаются ребенку от родителей.Как получить профессию генетика?
Чтобы стать генетиком, в первую очередь, необходимо получить высшее образование в сфере общей медицины. После этого нужно пройти специализацию по генетике , которая проводится на кафедрах по подготовке генетиков при разных учебных заведениях. Обучение специализации длится примерно 2 года.При прохождении специализации генетика изучаются следующие дисциплины:
- Общая генетика человека. Эта наука изучает закономерность передачи по наследству тех или иных как нормальных, так и аномальных особенностей организма.
- Клиническая генетика. Этот раздел медицины изучает характер (происхождение, развитие, последствия ) наследственных заболеваний.
- Современные методы диагностики. Эта дисциплина включает изучение специфики проведения и расшифровки различных анализов, которые могут быть назначены генетиком.
- Физиология человека. Наука, изучающая структуру и функции как отдельных органов и тканей, так и их совокупную деятельность, которая обеспечивает жизнедеятельность организма.
- Экологическая генетика. Это раздел генетики, который изучает влияние окружающей среды на человеческий организм, возможные изменения под действием экологии и их способность передаваться по наследству.
- Фармакогенетика. Эта дисциплина изучает влияние наследственности на реакцию организма, которая может возникнуть при приеме тех или иных лекарств.
Пациенты генетика
Основную категорию пациентов генетика составляют люди, которые по собственному желанию или показаниям врача хотят узнать вероятность наследственного заболевания у планируемого или вынашиваемого ребенка. При продолжительных неудачных попытках зачать ребенка тоже обращаются к этому специалисту, для того чтобы проверить, не является ли причиной генетическое бесплодие . Для получения достоверных данных осуществляется оценка генетического риска, которая заключается в проведении различных дородовых исследований.Также к этому доктору обращаются те, кто уже столкнулся с проявлением какой-нибудь генетической болезни. Таким пациентам проводится диагностика (в случае если диагноз не установлен ), назначается лечение (если целесообразно ) или профилактические меры для предупреждения рецидивов (повторных обострений ) болезни.
В чем заключается работа генетика?
Работа генетика, как и любого другого врача, заключается в оказании компетентной помощи пациентам. Вначале проводится опрос, в ходе которого врач задает вопросы как о пациентах (чаще это пары, которые планируют завести ребенка или уже ждут его ), так и об их близких родственниках.В ходе опроса генетик уточняет следующие данные:
- наличие неудачных беременностей (выкидыши , аборты );
- наличие тех или иных генетических патологий у мужчины и женщины, которые планируют завести или ждут ребенка;
- сведения о заболевании родственников (как правило, затрагивается не менее 3 поколений );
- наличие в семье старшего ребенка с теми или иными патологиями;
- вредные факторы, с которыми приходится сталкиваться пациентам в быту или на работе (проживание вблизи крупных заводов, частое взаимодействие с химическими веществами ).
Вопросы профилактики генетических заболеваний также являются важной составляющей работы генетика. Кроме диагностики, лечения и профилактики генетических заболеваний у генетика существуют и другие профессиональные обязанности.
Генетик на рабочем месте выполняет следующие действия:
- организация реабилитации больного (при тяжелых наследственных недугах );
- выписка необходимых документов (больничных листов, направлений к другим специалистам );
- организация и контроль персонала, который находится в подчинении (медсестры, санитары ).
В задачи генетика входит объяснить будущим родителям важность предварительного обследования перед зачатием, соблюдение врачебных предписаний и других мер предосторожности. Также врач на образовательных мероприятиях рассказывает о факторах риска и профилактике наследственных заболеваний.
С какими заболеваниями сталкивается генетик?
 В своей практике генетик сталкивается с генетическими заболеваниями, которые делятся на две группы - хромосомные и генные. Хромосомные патологии – это болезни, возникающие в результате мутации хромосом у одного из родителей или у плода. Генные болезни развиваются по причине деформации определенных участков (называются гены
) макромолекулы ДНК, которая отвечает за хранение и передачу наследственной информации. Также генетик занимается такой группой патологий как многофакторные болезни.
В своей практике генетик сталкивается с генетическими заболеваниями, которые делятся на две группы - хромосомные и генные. Хромосомные патологии – это болезни, возникающие в результате мутации хромосом у одного из родителей или у плода. Генные болезни развиваются по причине деформации определенных участков (называются гены
) макромолекулы ДНК, которая отвечает за хранение и передачу наследственной информации. Также генетик занимается такой группой патологий как многофакторные болезни.Какие хромосомные заболевания лечит генетик?
Эта группа представлена большим количеством заболеваний, которые проявляются множественными отклонениями в физическом развитии и нередко сопровождаются умственной отсталостью .В практике генетика наиболее распространены следующие хромосомные заболевания:
- Синдром Дауна. Самое распространенное и хорошо изученное заболевание из этой группы. Причиной развития синдрома Дауна становится лишняя хромосома, которая формируется в момент оплодотворения яйцеклетки (то есть у ребенка с синдромом Дауна здоровые родители, но при соединении их биоматериала происходит «сбой» ). Проявляется болезнь характерной внешностью (косым разрезом глаз, широкой переносицей, полуоткрытым ртом ), слабоумием , слабой иммунной системой.
- Синдром Патау. Также развивается по причине лишней хромосомы, которая формируется при оплодотворении. Проявляется выраженными физическими аномалиями, которые нередко приводят к смерти плода еще в материнской утробе. Появившиеся на свет дети с этим синдромом в развитых странах доживают до 1 года примерно в 15 процентах случаев.
- Синдром Клайнфельтера. Встречается только у пациентов мужского пола и часто обнаруживается тогда, когда пара обращается к генетику по поводу бесплодия, так как эта аномалия делает мужчину стерильным. К внешним признакам синдрома Клайнфельтера можно отнести высокий рост (не менее 180 сантиметров ), у некоторых пациентов отмечаются увеличенные молочные железы . У одних больных интеллект нормальный, у других могут присутствовать малозначительные отклонения от нормы.
- Синдром Шерешевского-Тернера. Патология проявляется исключительно физическими аномалиями - дефектами строения половых органов, низкорослостью, короткой шеей, кожными складками в области шеи. В большинстве случаев люди с этим синдромом бесплодны, но при проведении компетентного лечения возможно зачатие.
Какие генные заболевания лечит генетик?
Генные заболевания проявляются расстройством обмена какой-нибудь группы веществ (липидов , аминокислот, металлов, белков ), что ведет к дисфункции некоторых органов, отклонениям в физическом развитии. Проблемы с умственным здоровьем при генных патологиях встречаются редко.В практике генетика могут встречаться следующие болезни:
- Гемофилия. Причиной патологии является недостаточный синтез белков, которые отвечают за свертываемость крови. При нарушении целостности сосудов у таких больных начинается обильное кровотечение . В результате этого возникает опасность гибели пациента из-за внутреннего кровотечения или внешних потерь крови даже при небольших травмах или порезах . Гемофилией страдают мужчины, а женщины являются носителем мутированного гена.
- Талассемия. Еще одно заболевание крови , при котором вырабатывается недостаточное количество гемоглобина . Проявляется талассемия желтушным оттенком кожи , большими размерами живота, замедленным ростом тела. Угрозы для жизни данное заболевание не представляет, но при тяжелых формах необходимо регулярно проводить переливания крови и принимать специальные препараты.
- Ихтиоз. При этой болезни из-за неправильного белкового и жирового обмена нарушается процесс ороговения кожи, в результате чего тело пациента покрывается толстыми жесткими чешуйками. У таких больных также отмечается склонность к аллергиям , заболеваниям печени , сердца и кровеносной системы. Если первые симптомы проявляются после рождения (как правило, на 3 – 4 месяц ), при соответствующем лечении и легкой разновидности ихтиоза (их существует порядка 28 видов ), прогноз благоприятный. Если же ребенок рождается уже с проявлениями ихтиоза, то в большинстве случаев он погибает в первые дни жизни.
- Муковисцидоз. У пациентов с этим заболеванием нарушается функциональность органов, которые продуцируют слизь (слюнные железы, легкие , половые железы ). Выделяемый секрет отличается повышенной густотой и вязкостью, из-за чего возникают проблемы с функциональностью многих органов. В европейских странах средний возраст выживаемости при муковисцидозе составляет 40 лет, в Российской Федерации – не больше 30 лет.
- Синдром Марфана. При этой патологии нарушается выработка вещества, обеспечивающего здоровую структуру соединительной ткани, что приводит к проблемам со стороны опорно-двигательного аппарата, сердечно-сосудистой и нервной систем. Пациенты с синдромом Марфана отличаются худобой, высоким ростом при довольно коротком туловищем, непропорционально длинными и тонкими руками, ногами, пальцами. Интересно, что синдромом Марфана страдал, например, Авраам Линкольн. При адекватном лечении прогноз при этой болезни благоприятен.
Какими многофакторными болезнями занимается генетик?
Многофакторные заболевания – это патологии, развитие которых определяет не только наследственность, но и другие факторы. Также такие заболевания называют болезнями с наследственной предрасположенностью.Различают следующие многофакторные болезни:
- Плоскостопие. Деформация правильной формы стопы, в результате чего человек быстрее устает при ходьбе. Плоскостопие может проявляться как с рождения, так и на любом году жизни.
- Сахарный диабет. Сахарный диабет - это нарушение водного и углеводного обмена, что проявляется повышенным содержанием сахара в крови.
- Язва желудка. Язва желудка - это нарушение целостности слизистой желудка , в результате чего пациенты (чаще мужчины ) испытывают боли в области живота , нарушения стула и другие проблемы с пищеварением.
- Заячья губа. Аномалия, при которой ребенок рождается с видимой расщелиной на верхней губе. При своевременной проведенной операции (одной или нескольких ) дефект устраняется практически бесследно. На тот факт, проявится ли у ребенка данная патология, большое влияние оказывает курение беременной женщины, употребление алкоголя, наличие инфекционных заболеваний во время вынашивания ребенка.
- Бронхиальная астма. Бронхиальная астма - это воспаление легких хронического типа, которое сопровождается приступами сильного кашля , одышки , чувством нехватки воздуха.
- Шизофрения. Шизофрения - это расстройство психики, при котором у пациента нарушается процесс восприятия окружающего мира и мышление. Проявления болезни многозначительны и во многом зависят от пола и возраста больного.
На болезни с наследственной предрасположенностью оказывают влияние следующие факторы:
- Образ жизни человека. Чем крепче физическое и психическое здоровье, тем меньше вероятность развития той или иной болезни.
- Пол. Некоторые патологии чаще проявляются, например, у мужчин. Также пол человека может влиять на интенсивность проявления болезни.
- Окружающая среда. Влияние неблагоприятных экологических факторов (загрязненный воздух и вода, продукты питания с нитратами ) увеличивают риск развития многих заболеваний.
Какие анализы и обследования может назначить генетик?
 Среди всех анализов и обследований, которые может назначить генетик, наибольшим значением обладает пренатальная (дородовая
) диагностика. Такие исследования назначаются как парам, которые только планируют беременность , так и женщинам, уже вынашивающим ребенка. Целью дородовых обследований является оценка генетического риска, то есть вероятности того, что ребенок родится с генетической патологией.
Среди всех анализов и обследований, которые может назначить генетик, наибольшим значением обладает пренатальная (дородовая
) диагностика. Такие исследования назначаются как парам, которые только планируют беременность , так и женщинам, уже вынашивающим ребенка. Целью дородовых обследований является оценка генетического риска, то есть вероятности того, что ребенок родится с генетической патологией.Пренатальная диагностика включает инвазивные (подразумевают вмешательство внутри организма ) и неинвазивные (без вмешательства ) методы. Инвазивные способы исследования назначаются пациенткам, которые уже вынашивают ребенка. Неинвазивные анализы могут быть проведены как при планировании беременности, так и во время нее.
Инвазивные анализы у генетика при беременности
Анализы инвазивного типа назначаются, для того чтобы определить, существуют ли у плода какие-либо генетические отклонения.Генетик может назначить следующие анализы при беременности:
- амниоцентез (записаться ) ;
- плацентоцентез;
- кордоцентез;
- фетоскопия.
Целью этого анализа является лабораторное исследование жидкости, которая окружает плод в утробе женщины (также называется околоплодной или амниотической жидкостью ). Чтобы получить материал для анализа, врач прокалывает брюшную стенку пациентке тонкой иглой. Во время процедуры проводится мониторинг (контроль ) состояния женщины при помощи ультразвукового сканера. В зависимости от болевого порога пациентки амниоцентез проводится совсем без обезболивания, либо используется местная анестезия .
Оптимальным сроком для проведения амниоцентеза является период с 16 по 18 неделю беременности, когда размеры плода еще невелики, но уже достаточно околоплодных вод.
Полученная жидкость (не более 30 миллилитров
) отправляется на генетический анализ. Данные такого исследования позволяют выявить у плода наличие таких серьезных хромосомных заболеваний как синдром Дауна, синдром Патау.
Кордоцентез
Это исследование проводится путем прокалывания пуповины плода для изъятия его крови и ее последующего изучения в лаборатории. Прокол проводится через брюшную стенку беременной женщины. Количество материала, требуемого для анализа, варьирует от 1 до 5 миллилитров. Оптимальное время для проведения этого анализа – с 21 по 25 неделю беременности. Именно в этот период сосуды в пуповине достигают нужного размера, для того чтобы провести безопасный забор крови.
Кордоцентез является более информативным анализом, чем амниоцентез. С его помощью можно выявить не только хромосомные патологии, но и болезни крови, мышечную дистрофию , различные внутриутробные инфекции . В большинстве случаев процедура проводится без какого-либо наркоза, но после нее пациентка должна оставаться несколько часов под наблюдением врача.
Плацентоцентез
В ходе этой процедуры осуществляется изъятие небольшого фрагмента плаценты , который затем подвергается лабораторному анализу. В большинстве случаев требует общего или местного наркоза. После проведения плацентоцентеза женщина должна находиться под врачебным наблюдением не менее 2 дней.
Этот анализ позволяет определить наличие у плода различных разных наследственных аномалий, которые сопровождаются умственными или физическими патологиями. В отличие от 2 предыдущих исследований плацентоцентез можно проводить на более ранних сроках (начиная с 12 недели беременности ), что и определяет его ценность.
Фетоскопия
Это исследование проводится при помощи фетоскопа (тонкой трубки, оснащенной источником света и линзами
), который вводится через небольшие разрезы в животе беременной женщины. С помощью прибора врач осматривает плод с целью выявления видимых физических аномалий. Также во время фетоскопии может быть изъят биоматериал плода (кровь, фрагменты кожи
) для изучения в лаборатории.
Фетоскопия является одним из самых информативных анализов и позволяет выявить редкие заболевания, которые не могут быть установлены при помощи других диагностических процедур. Вместе с тем это исследование относят к категории опасных и назначают редко, так как примерно в 5% случаев оно приводит к прерыванию беременности.
Показания к проведению инвазивных анализов
Показания для инвазивного исследования могут быть абсолютными или относительными. Абсолютными является те, которые обязательно требуют (в случае если нет противопоказаний ) проведения исследования. К ним относятся отягощенная наследственность (наличие заболеваний, которые передаются по наследству у отца или матери ), наличие старшего ребенка с той или иной генетической патологией, плохие результаты скрининга (плановых обследований во время беременности ). Возраст беременной женщины старше 35 – 40 лет также является абсолютным показанием к проведению одного из инвазивных анализов.При относительных показаниях врач определяет целесообразность проведения исследования, ориентируясь на состояние пациентки и другие факторы. К таким показаниям относятся сложное течение беременности, инфекции, сахарный диабет и другие эндокринные заболевания у беременной. Относительными показаниями для проведения такой процедуры также являются прием медикаментов с мутагенным действием, прохождение рентгена при беременности.
Противопоказания для инвазивной диагностики
Для каждого анализа, который проводится инвазивным методом, существуют особенные противопоказания. Но есть и общие противопоказания для всех видов таких диагностических процедур. Так, к ним относится инфекционное поражение кожи живота, так как через прокол инфекция может проникнуть к плоду. Острая форма или обострение какого-нибудь хронического заболевания, повышенная температура , общее неудовлетворительное состояние беременной также являются противопоказаниями для инвазивных процедур. Угроза прерывания беременности, патологии матки (миома , повышенный тонус ), аномалии плаценты – все эти состояния также являются противопоказаниями для инвазивных методов исследования.Неинвазивные анализы у генетика при планировании беременности и во время нее
Принцип большинства диагностических неинвазивных анализов, которые может назначить генетик, заключается в изъятии биоматериала (чаще крови ) пациентки (или и ее партнера ) для последующего лабораторного изучения.Различают следующие методы неинвазивных диагностических процедур:
- хромосомный анализ;
- анализ генетической совместимости;
- генетический анализ крови ;
- ультразвуковое исследование (УЗИ ).
Хромосомный анализ (также называется анализ на кариотип ) назначается мужчине и женщине в период планирования ребенка. Цель исследование – изучить количественный и качественный состав хромосом у обоих супругов. Для проведения анализа осуществляется забор венозной крови (иногда и спермы ), из которой затем выделяются необходимые вещества и подвергаются изучению. Это исследование позволяет выявить мутации хромосом у мужчины или женщины, которые могут стать причиной развития у ребенка тех или иных аномалий.
Анализ на кариотип позволяет установить следующие аномалии:
- Лишняя хромосома. Проявляется синдромом Дауна, синдромом Патау и другими заболеваниями, которые сопровождаются задержкой умственного развития. Следует отметить, что пациенты с этой аномалией редко обращаются к генетику по поводу планирования ребенка, так как она редко протекает незамеченной и с ранних лет приводит к инвалидности .
- Отсутствие одной хромосомы. Диагностируется только у женщин и приводит к бесплодию, а также некоторым аномалиям в развитии.
- Отсутствие участка хромосомы. В зависимости от того, какой именно участок хромосомы отсутствует, может проявляться физическими уродствами (расщелиной в небе, лишними пальцами ), болезнями разных органов (чаще печени ), проблемами с умственным развитием. У мужчин отсутствие участка хромосомы становится причиной бесплодия.
- Удвоение кончика хромосомы. Может стать причиной болезни
